Сопутствующая микробиота культуры Arthrospira (Spirulina) platensis в условиях смены лимитирующих факторов
##plugins.themes.ibsscustom.article.main##
##plugins.themes.ibsscustom.article.details##
Аннотация
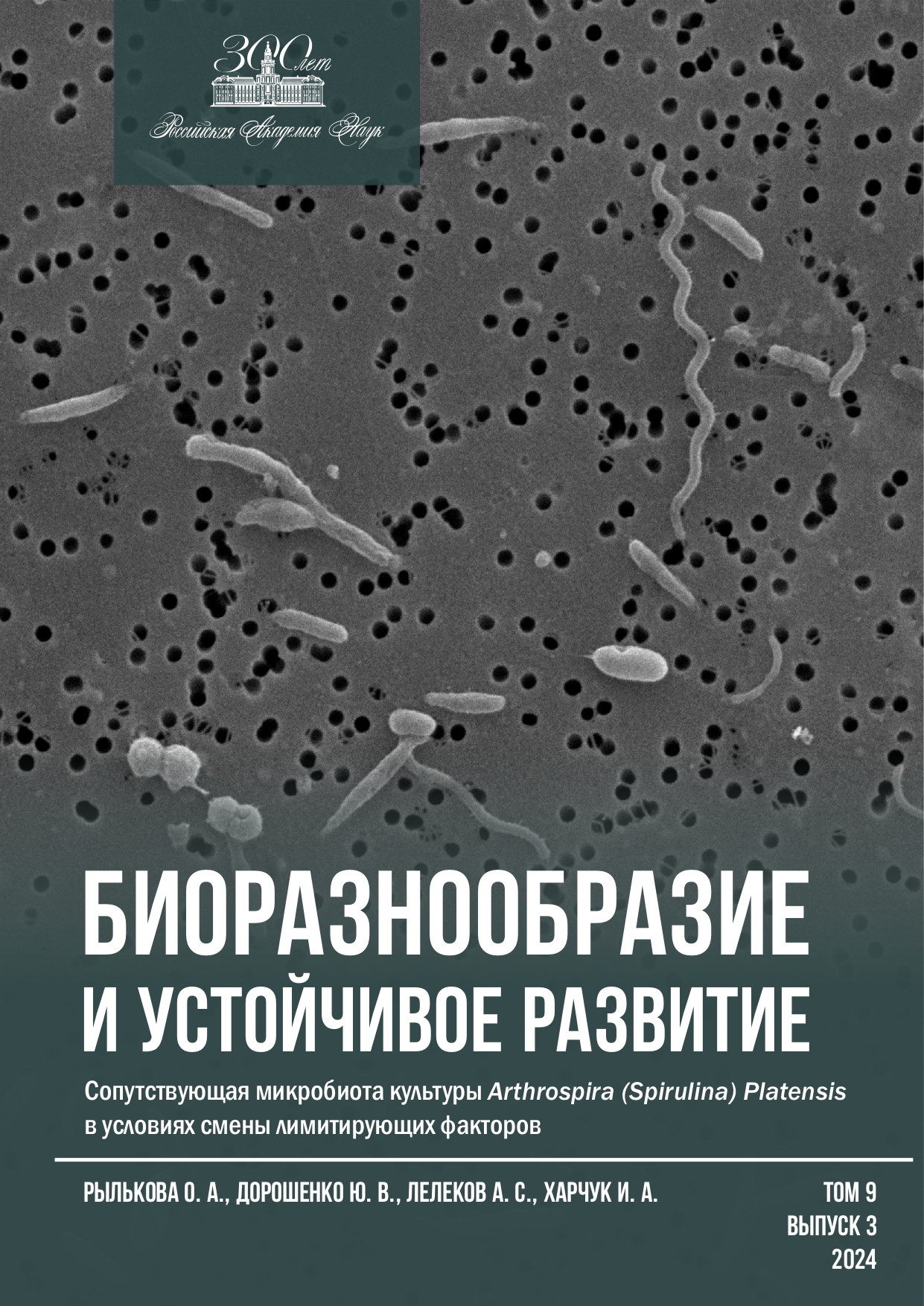
В природных и в лабораторных условиях цианобактерии и микроводоросли сосуществуют с микробными сообществами, которые могут оказывать стимулирующее или ингибирующее воздействие на физиологию, рост и развитие альгокультур. Для оценки бактериальной контаминации и определения доли сопутствующей микробиоты в культуре рlatensis изучены количественный состав, разнообразие физиологических групп и морфологической структуры бактериального ассоциата в различных фазах роста накопительной и проточной культур цианобактерий. В работе использованы стандартные методы исследований накопления биомассы A. рlatensis, микробиологический, микроскопический и цитометрический подходы при исследовании сопутствующей микробиоты. Показано, что численность гетеротрофов, по данным проточной цитометрии, после окраски флуорохромом SYBR Green (0,3·108–1,6·108 кл.·мл-1) превышала значения, полученные при посевах на твёрдых средах (5·106–1,3·108 КОЕ·мл-1). Динамика изменений количественных показателей, полученная этими методами, была схожая: минимальные величины получены в экспоненциальной, а максимальные — в первой стационарной фазе роста. Проточная цитометрия значительно упрощала учёт бактериального ассоциата, однако при работе с культурой А. platensis необходима предварительная физико-химическая пробоподготовка. При минимальных количествах бактерий-спутников наблюдали как разнообразие физиологических групп, так и морфотипов сопутствующих микроорганизмов. На I стационарной стадии, на фоне высокой численности, при максимальном рН (11,8) доминировали алкалифильные микроорганизмы (98,8 %), представленные палочковидными бактериями различной длины (87 %). Развитие остальных физиологических групп, вероятно, ингибировалось высокой щёлочностью среды. На этапе II стационара, на фоне некоторого снижения рН и численности микробиоты, алкалифильная микробиота продолжала доминировать (82 %), однако возрастал (до 16 %) вклад дрожжей и грибов. Таким образом, рН культуральной среды при выращивании спирулины в значительной мере определяет и численность, и разнообразие бактериального сообщества. Несмотря на небольшой вклад, ассоциированная микрофлора может оказывать влияние на качество получаемой биомассы низших фототрофов при их промышленном выращивании. Проведённые исследования позволяют дать рекомендации по режимам культивирования и сбора биомассы A. рlatensis.
Авторы
Библиографические ссылки
Борисова Е. В. Видовой состав бактерий, сопутствующий микроводорослям в культуре (Обзор литературы) // Альгология. – 1996. – Т. 6, № 3. – С. 303–313.
Гольдин Е. Б. Биологическая активность микроводорослей и ее значение в межвидовых взаимоотношениях // Экосистемы, их оптимизация и охрана. – 2013. – Вып. 9. – С. 49–76.
Дудниченко Т. И. Изучение взаимоотношений Haematococcus pluvialis Flotow et Wille (Chlorophyta) и сопутствующих бактерий // Альгология. – 1999. – Т. 9, № 2. – С. 47.
Игнатенко М. Е., Немцева Н. В. Механизмы взаимодействия автотрофного и гетеротрофного компонентов в альгобактериальных сообществах // Бюллетень Оренбургского научного центра УрО РАН. – 2012. – № 3. – URL: http://elmag.uran.ru:9673/magazine/Numbers/2012-3%20/Articles/7IgnatenkoME.pdf. – Дата публ.: не указ.
Комиссарова А. В., Икромова С. Б. Микроводоросль спирулина: культивирование и особенности её биохимического состава // Аллея Науки. – 2020. – № 11, т. 1. – C. 186–190. – URL: https://alley-science.ru/domains_data/files/Collection_of_journals/Noyabr_1_tom2020.pdf. – Дата публ.: не указ.
Кублановская А. А. Микробные сообщества каротиногенной микроводоросли Haematococcus lacustris (Girod-Chantrans) Rostafinski (Chlorophyta) в природе и при культивировании : авто-реф. дис. ... канд. биол. наук : 03.02.01. – Москва, 2019. − 24 с.
Куприянова Е. В., Самылина О. С. СО2-концентрирующий механизм и его особенности у галоалкалофильных цианобактерий // Микробиология. – 2015. – Т. 84, № 2. – C. 144–159. – https://doi.org/10.7868/S0026365615010073
Лелеков А. С. Количественные закономерности роста микроводорослей в культуре и параметры управления процессом фотобиосинтеза : автореф. дис. ... д-ра биол. наук : 1.5.2. – Севастополь, 2023. − 45 с.
Практикум по микробиологии / под ред. А. И. Нетрусова. – Москва : Academia, 2005. – 603 с.
Родина А. Г. Методы водной микробиологии : практ. рук. – Москва : Наука, 1965. – 364 с.
Тархова Э. П. Микроорганизмы, сопутствующие Spirulina platensis в накопительной культуре // Экология моря / НАН Украины, Ин-т биологии юж. морей им. А. О. Ковалевского. – Севастополь, 2005. – Вып. 70. – С. 49–52.
Тиберкевич Н. Я., Сакевич А. И. Коррелятивные связи между фотосинтезом и количеством бактерий-спутников в культурах водорослей // Альгология. – 1999. – Т. 9, № 2. – С. 141.
Троицкий А. С., Сорокин Ю. И. К методике расчёта биомассы бактерий в водоёмах // Труды Института биологии внутренних вод АН СССР. – Борок, 1967.– Вып. 15. – С. 85–90.
Хаддад Р. И., Багдасарян С. Н., Давидян Т. С., Африкян Э. К. Микроводоросль спирулина и ее микрофлора // Биологический журнал Армении. – 1990. – Т. 43, № 3. – С. 235–239.
Чекушкин А. А., Авсиян А. Л., Лелеков А. С. Продуктивность культуры Arthrospira platensis Gomont 1892 в условиях естественного освещения // Труды Карадагской научной станции им. Т. И. Вяземского – природного заповедника РАН. – 2022. – № 4. – С. 33–44. – https://doi.org/10.21072/eco.2022.24.02
AlSulaiman M. A. Microbiological quality of locally produced Spirulina in comparison with a commercial sample // Biosciences. Biotechnology Research. Asia. – 2011. – Vol. 8, nr 1. – P. 137–141. – https://doi.org/10.13005/bbra/835
Azarpour А., Zendehboudi S., Mohammadzadeh O., Rajabzadeh A., Chatzis I. A review on microalgal biomass and biodiesel production through co-cultivation strategy // Energy Conversion and Management. – 2022. – Vol. 267. – Art. 115757. – https://doi.org/10.1016/j.enconman.2022.115757
Borowitzka M. A. High-value products from microalgae – their development and commercialization // Journal of Applied Phycology. – 2013. – Vol. 25, iss. 3. – P. 743–756. – https://doi.org/10.1007/s10811-013-9983-9
Bratbak G. Microscope methods for measuring bacterial biovolume: epifluorescence microscopy, scanning electron microscopy, and transmission electron microscopy // Handbook of Methods in Aquatic Microbial Ecology / ed. by P. F. Kemp [et al.]. – Boca Raton : Lewis Publ., 1993. – P. 309–316. – https://doi.org/10.1201/9780203752746
Chroeder D. C., Oke J., Hall M., Malin G., Wilson W. H. Virus succession observed during an Emiliania huxleyi bloom // Applied and Environmental Microbiology. – 2003. – Vol. 69, iss. 5. – P. 2484–2490. – https://doi.org/10.1128/AEM.69.5.2484-2490.2003
Falquet J., Hurni J.-P. Spiruline. Aspects Nutritionnels. – [S. l.] : Antenna Technologies, 2006. – 41 р.
Flynn K. J., Kenny P., Mitra A. Minimising losses to predation during microalgae cultivation // Journal of Applied Phycology. – 2017. – Vol. 29, iss. 4. – P. 1829–1840. – https://doi.org/https://doi.org/10.1007/s10811-017-1112-8
Gorobets O. B., Blinkova L. P., Baturo A. P. Effect of microalgae on viability of microorganisms in the natural and artificial environment // Journal of Microbiology, Epidemiology and Immunobiology. – 2001. – Iss. 1. – P. 104–108.
Kallmeyer J., Smith D. C., Spivac A. J., D’Hondt S. New cell extraction procedure applied to deep subsurface sediments // Limnology and Oceanography: Methods. – 2008. – Vol. 6, iss. 6. – P. 236–245. – https://doi.org/10.4319/lom.2008.6.236
Lafarga T., Fernández-Sevilla J. M., González-López C., Acién-Fernández F. G. Spirulina for the food and functional food industries // Food Research International. – 2020. – Vol. 137. – Art. 109356. – https://doi.org/10.1016/j.foodres.2020.109356
Lee S. S., Furman J. A. Relationships between biovolume and biomass of naturally derived marine bacterioplankton // Applied and Environmental Microbiology. – 1987. – Vol. 53, nr 6. – P. 1298–1303. – https://doi.org/10.1128/aem.53.6.1298-1303.1987
Lunau M., Lemke A., Walther K., Martens-Habbena W., Simon M. An improved method for counting bacteria from sediments and turbid environments by epifluorescence microscopy // Environmental Microbiology. – 2005. – Vol. 7, iss. 7. – P. 961–968. – https://doi.org/10.1111/j.1462-2920.2005.00767.x
Marie D., Partensky F., Jacquet S., Vaulot D. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I // Applied and Environmental Microbiology. – 1997. – Vol. 63, nr 1. – P. 186–193. – https://doi.org/10.1128/aem.63.1.186-193.1997
Muys M., Sui Y., Schwaiger B., Lesueur C., Vandenheuvel D., Vermeir P., Vlaeminck S. E. High variability in nutritional value and safety of commercially available Chlorella and Spirulina biomass indicates the need for smart production strategies // Bioresource Technology. – 2019. – Vol. 275. – P. 247–257. – https://doi.org/10.1016/j.biortech.2018.12.059
Noble R. T., Fuhrman J. A. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria // Aquatic Microbial Ecology. – 1998. – Vol. 14, iss. 2. – P. 113–118. – https://doi.org/10.3354/ame014113
Qin L., Yin Z., Li Y., Tian L., Zhu L. Exploring the way forward: current status and new upgrading trends of the research on microalgae-based wastewater treatment // Journal of Water Process Engineering. – 2024. – Vol. 64. – Art. 105581. – https://doi.org/10.1016/j.jwpe.2024.105581
Shiraishi H. Association of heterotrophic bacteria with aggregated Arthrospira platensis exopolysaccharides: implications in the induction of axenic cultures // Bioscience, Biotechnology and Biochemistry. – 2015. – Vol. 79, iss. 2. – P. 331-341. – https://doi.org/10.1080/09168451.2014.972333
Smith V. H., Foster B. L., Grover J. P., Holt R. D., Leibold M. A., deNoyelles F. Phytoplankton species richness scales consistently from laboratory microcosms to the world’s oceans // Proceedings of the National Academy of Science of the USA. – 2005. – Vol. 102, iss. 12. – P. 4393–4396. – https://doi.org/10.1073/pnas.0500094102
Strittmatter M., Guerra T., Silva J., Gachon C. M. M. A new flagellated dispersion stage in Paraphysoderma sedebokerense, a pathogen of Haematococcus pluvialis // Journal of Applied Phycology. – 2016. – Vol. 28, iss. 3. – P. 1553–1558. – https://doi.org/10.1007/s10811-015-0700-8
Wu J. F., Pond W. G. Amino acid composition and microbial contamination of Spirulina maxima, a blue-green alga, grown on the effluent of different fermented animal wastes // Bulletin of Environmental Contamination and Toxicology. – 1981. – Vol. 27, iss. 1. – P. 151–159. – https://doi.org/10.1007/BF01611001
Zarrouk C. Contribution a l’etude d’une cyanobacterie: influence de divers facteurs physiques et chimiques sur la croissance et la photosynthese de Spirulina maxima : PhD thesis. – Paris, 1966. – 138 p.
Zobell C. E. The effect of solid surfaces upon bacterial activity // Journal of Bacteriology. – 1943. – Vol. 46, no. 1. – P. 39–56. – https://doi.org/10.1128/jb.46.1.39-56.1943
 Google Scholar
Google Scholar